全球新冠疫情的命运几何,很可能只由长度为几百纳米的生物积木所决定。
对于来自Moderna和辉瑞(Pfizer)及其合作伙伴BioNTech的两种主要候选疫苗来说,mRNA是核心所在。这两家公司的临床试验数据表明,其疫苗有效率均达到了95%左右。辉瑞公司的疫苗已经在英国获得批准,并可能在几周内开始分发给部分美国公民。
这场疫苗分发、全球免疫的挑战,在世界历史上可谓前所未有。与这一挑战同样引人注目的是,在科学的引领和催化之下,疫苗在不到一年的时间里诞生——通常情况下,这一过程需要五年甚至更久。以辉瑞和Moderna的疫苗为例,两家公司先进的技术,让扩大生产变得容易得多。
我们不禁要问,疫苗是如何制造出来的呢?学术机构和制药公司又是如何在新冠疫情期间如此迅速地取得成功的?
疫苗何以从病毒中“脱胎”而生
药物从不会凭空产生。不管是治疗用药品,还是预防疾病的疫苗,药物的创造、诞生都是充满趣味的一个过程。而这一过程的第一步,就是对“生物敌人”进行彻底的检查。
休斯顿贝勒医学院国家热带医学院(National School of Tropical Medicine at Houston’s Baylor College of Medicine)院长彼得•霍特兹说:“制造疫苗的第一步就是找出病原体的弱点,以确定疫苗进军的目标。”
疫苗的基本作用是诱导免疫反应,通过身体产生抗体来攻击抗原,达到保护身体免受病原体侵害的作用。所谓抗原,是指病原体产生免疫反应的组成部分。当真正的病毒来袭时,身体已经“认识”了入侵者,可以快速调用它的抗体库,以抵抗病原体袭击。
许多普通疫苗本身含有少量的病毒或细菌。这些病毒或细菌在实验室培养完成后被杀死,即使存活,活性也已大大削弱,致病可能性不大。
就新冠病毒而言,识别霍特兹所说的“病原体的弱点”是至关重要的第一步。在这过程中,一种叫做刺突蛋白的物质格外凶险,同时也很关键。
“当说到冠状病毒时,每个人都会想起这样的病毒图片,它有着一簇簇刺突蛋白,即从圆柱形病毒复合物上突出的红色部分。”Seyfarth Shaw LLP公司华盛顿特区办公室的知识产业部成员迪恩•法内利说。
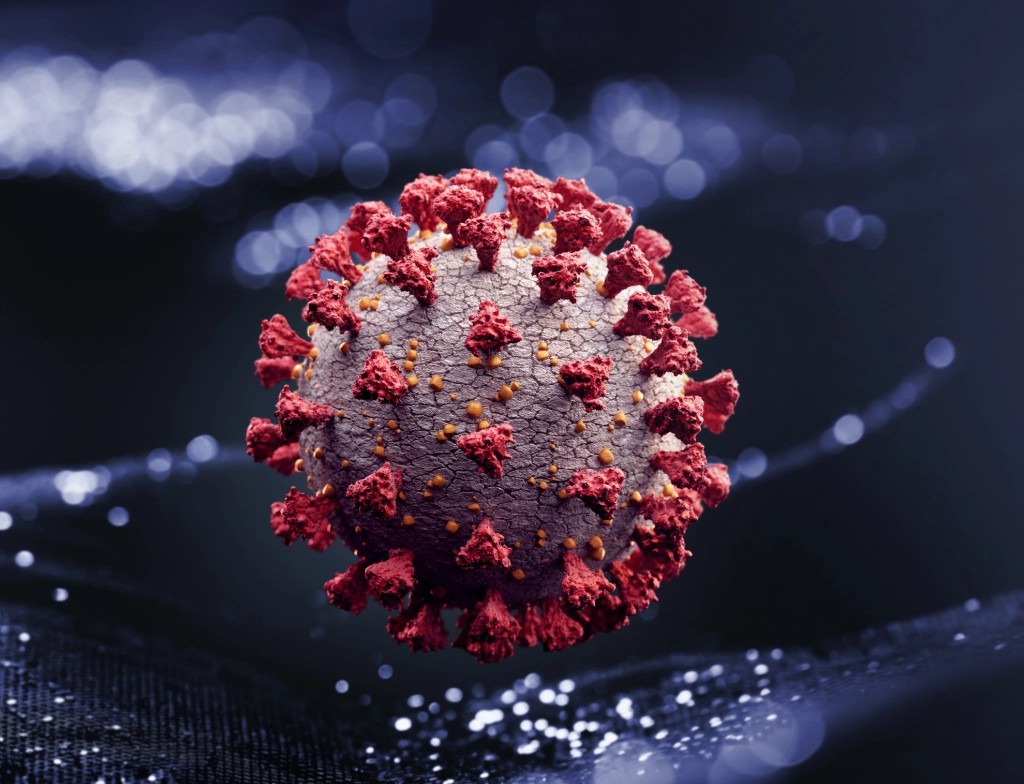
“刺突蛋白”的作用和你想象中的刺突物体的作用完全一样——刺穿其他东西。“这种刺突蛋白附着在人类细胞中的ACE2蛋白上,因此我们也就知道了这种病毒感染人类的方式。”法内利补充说。
制药企业知道,他们生产的疫苗必须“教会”人们的身体,去攻击刺突蛋白上吸引抗体的抗原。但是辉瑞和Moderna的研发方式与传统疫苗相比,二者截然不同。
制作mRNA疫苗
mRNA是一种强大的生物学工具。实际上,正是这种分子指导着细胞合成哪些物质,例如蛋白质。
从理论上来说,这意味着人们可以利用mRNA将人体细胞转变成微型的制药工厂,生成抵抗各种疾病的物质。但就在一年前,许多生物技术界人士都对使用mRNA技术来进行治疗的方法提出了质疑。
但在一众疫苗中处于领先的mRNA疫苗采用的正是这种作用机制。今年早些时候,中国的科学家破译了新冠病毒的基因密码,并向全球公布。借助这一信息,制药商已能明白应如何利用mRNA来迫使人体模仿新冠病毒这种特殊的蛋白结构,并诱导免疫反应。
本质上,这种技术比传统的疫苗制造过程落后了一步。使用mRNA技术生产疫苗的辉瑞/BioNTech和Moderna并没有将病毒中能唤醒免疫系统的表面蛋白结构直接注射到人体内,而是注射了带有此类蛋白编码的RNA。
菲尔•多米特泽(Phil Dormitzer)是RNA疫苗的坚定推广者,也是辉瑞疫苗部门的副总裁兼首席科学官。
他说:“我已经考虑RNA疫苗很久了。2018年,在我们与BioNTech一致同意启动新的mRNA计划后,便开始投入了这项进程。”这项合作一开始的目的是想要开发基于mRNA的流感疫苗。但新冠疫情一爆发,他们的研发重点就转移了。
多米特泽列举了他对这项技术充满热情的两个具体原因:灵活性,以及快速投入大规模量产并扩大治疗范围的能力。他解释说,使用RNA疫苗时,免疫反应可以同时产生抗体和另一种关键的免疫物质——T细胞,这一点很重要,因为如果免疫系统中有两种免疫物质,一种失效的话还有另一种可以互补,就可以更有效地抵抗新冠病毒。
当疫苗的生产规模必须大幅增加,以满足在全球范围内分发的要求时,第二个原因尤其重要。
“我认为很多人都会倾向于使用mRNA,因为在一天之内就可以制作出一条mRNA,对吧?”贝勒医学院的霍特兹教授说。“而且有些公司可以通过外包的方式,为人们制作mRNA。”
与传统的疫苗不同,mRNA技术不必花数月时间手动收集并提纯病原体中的抗原,即可制成最终产品。人们可以简单地使带有指令的mRNA序列进入人体。之后,人体的细胞会自行完成繁重的免疫工作。
这就是为什么辉瑞和Moderna的疫苗可以超越竞争对手、率先进入审批环节的原因之一,并且得益于此,它们还有可能在2021年底之前,追加数亿剂疫苗的生产。
新冠疫苗大军
要想最终战胜新冠疫情,可能需要用各种不同技术制成的疫苗。并非所有疫苗都要使用mRNA技术。
例如霍特兹的小组一直在研究的疫苗,采用的就是一种更为传统的技术,即腺病毒重组技术。
他说:“像其他团队一样,我们也开始合成这种新型的冠状病毒。只是为了达到这一目的,不同的研究团队用的是不同的技术,mRNA或者腺病毒。而且每种技术各有利弊。”
对于辉瑞公司而言,一个更复杂的问题是,其疫苗的存储需要极端低温条件,约为零下70摄氏度。正是由于其疫苗中特殊的mRNA成分,如果冷冻得不彻底,就可能会分解。辉瑞公司甚至不得不想出定制一种特殊的高科技存储运输箱的方法来应对这一难题。
因此,尽管mRNA疫苗存在一些问题,但它们的快速性正是目前所需要的。下一个艰巨的挑战是疫苗的分发,还需要说服人们接种疫苗——在这场疫情之中,人们还会迎来其他许多前所未有的挑战。(财富中文网)
编译:陈聪聪、杨二一
全球新冠疫情的命运几何,很可能只由长度为几百纳米的生物积木所决定。
对于来自Moderna和辉瑞(Pfizer)及其合作伙伴BioNTech的两种主要候选疫苗来说,mRNA是核心所在。这两家公司的临床试验数据表明,其疫苗有效率均达到了95%左右。辉瑞公司的疫苗已经在英国获得批准,并可能在几周内开始分发给部分美国公民。
这场疫苗分发、全球免疫的挑战,在世界历史上可谓前所未有。与这一挑战同样引人注目的是,在科学的引领和催化之下,疫苗在不到一年的时间里诞生——通常情况下,这一过程需要五年甚至更久。以辉瑞和Moderna的疫苗为例,两家公司先进的技术,让扩大生产变得容易得多。
我们不禁要问,疫苗是如何制造出来的呢?学术机构和制药公司又是如何在新冠疫情期间如此迅速地取得成功的?
疫苗何以从病毒中“脱胎”而生
药物从不会凭空产生。不管是治疗用药品,还是预防疾病的疫苗,药物的创造、诞生都是充满趣味的一个过程。而这一过程的第一步,就是对“生物敌人”进行彻底的检查。
休斯顿贝勒医学院国家热带医学院(National School of Tropical Medicine at Houston’s Baylor College of Medicine)院长彼得•霍特兹说:“制造疫苗的第一步就是找出病原体的弱点,以确定疫苗进军的目标。”
疫苗的基本作用是诱导免疫反应,通过身体产生抗体来攻击抗原,达到保护身体免受病原体侵害的作用。所谓抗原,是指病原体产生免疫反应的组成部分。当真正的病毒来袭时,身体已经“认识”了入侵者,可以快速调用它的抗体库,以抵抗病原体袭击。
许多普通疫苗本身含有少量的病毒或细菌。这些病毒或细菌在实验室培养完成后被杀死,即使存活,活性也已大大削弱,致病可能性不大。
就新冠病毒而言,识别霍特兹所说的“病原体的弱点”是至关重要的第一步。在这过程中,一种叫做刺突蛋白的物质格外凶险,同时也很关键。
“当说到冠状病毒时,每个人都会想起这样的病毒图片,它有着一簇簇刺突蛋白,即从圆柱形病毒复合物上突出的红色部分。”Seyfarth Shaw LLP公司华盛顿特区办公室的知识产业部成员迪恩•法内利说。
“刺突蛋白”的作用和你想象中的刺突物体的作用完全一样——刺穿其他东西。“这种刺突蛋白附着在人类细胞中的ACE2蛋白上,因此我们也就知道了这种病毒感染人类的方式。”法内利补充说。
制药企业知道,他们生产的疫苗必须“教会”人们的身体,去攻击刺突蛋白上吸引抗体的抗原。但是辉瑞和Moderna的研发方式与传统疫苗相比,二者截然不同。
制作mRNA疫苗
mRNA是一种强大的生物学工具。实际上,正是这种分子指导着细胞合成哪些物质,例如蛋白质。
从理论上来说,这意味着人们可以利用mRNA将人体细胞转变成微型的制药工厂,生成抵抗各种疾病的物质。但就在一年前,许多生物技术界人士都对使用mRNA技术来进行治疗的方法提出了质疑。
但在一众疫苗中处于领先的mRNA疫苗采用的正是这种作用机制。今年早些时候,中国的科学家破译了新冠病毒的基因密码,并向全球公布。借助这一信息,制药商已能明白应如何利用mRNA来迫使人体模仿新冠病毒这种特殊的蛋白结构,并诱导免疫反应。
本质上,这种技术比传统的疫苗制造过程落后了一步。使用mRNA技术生产疫苗的辉瑞/BioNTech和Moderna并没有将病毒中能唤醒免疫系统的表面蛋白结构直接注射到人体内,而是注射了带有此类蛋白编码的RNA。
菲尔•多米特泽(Phil Dormitzer)是RNA疫苗的坚定推广者,也是辉瑞疫苗部门的副总裁兼首席科学官。
他说:“我已经考虑RNA疫苗很久了。2018年,在我们与BioNTech一致同意启动新的mRNA计划后,便开始投入了这项进程。”这项合作一开始的目的是想要开发基于mRNA的流感疫苗。但新冠疫情一爆发,他们的研发重点就转移了。
多米特泽列举了他对这项技术充满热情的两个具体原因:灵活性,以及快速投入大规模量产并扩大治疗范围的能力。他解释说,使用RNA疫苗时,免疫反应可以同时产生抗体和另一种关键的免疫物质——T细胞,这一点很重要,因为如果免疫系统中有两种免疫物质,一种失效的话还有另一种可以互补,就可以更有效地抵抗新冠病毒。
当疫苗的生产规模必须大幅增加,以满足在全球范围内分发的要求时,第二个原因尤其重要。
“我认为很多人都会倾向于使用mRNA,因为在一天之内就可以制作出一条mRNA,对吧?”贝勒医学院的霍特兹教授说。“而且有些公司可以通过外包的方式,为人们制作mRNA。”
与传统的疫苗不同,mRNA技术不必花数月时间手动收集并提纯病原体中的抗原,即可制成最终产品。人们可以简单地使带有指令的mRNA序列进入人体。之后,人体的细胞会自行完成繁重的免疫工作。
这就是为什么辉瑞和Moderna的疫苗可以超越竞争对手、率先进入审批环节的原因之一,并且得益于此,它们还有可能在2021年底之前,追加数亿剂疫苗的生产。
新冠疫苗大军
要想最终战胜新冠疫情,可能需要用各种不同技术制成的疫苗。并非所有疫苗都要使用mRNA技术。
例如霍特兹的小组一直在研究的疫苗,采用的就是一种更为传统的技术,即腺病毒重组技术。
他说:“像其他团队一样,我们也开始合成这种新型的冠状病毒。只是为了达到这一目的,不同的研究团队用的是不同的技术,mRNA或者腺病毒。而且每种技术各有利弊。”
对于辉瑞公司而言,一个更复杂的问题是,其疫苗的存储需要极端低温条件,约为零下70摄氏度。正是由于其疫苗中特殊的mRNA成分,如果冷冻得不彻底,就可能会分解。辉瑞公司甚至不得不想出定制一种特殊的高科技存储运输箱的方法来应对这一难题。
因此,尽管mRNA疫苗存在一些问题,但它们的快速性正是目前所需要的。下一个艰巨的挑战是疫苗的分发,还需要说服人们接种疫苗——在这场疫情之中,人们还会迎来其他许多前所未有的挑战。(财富中文网)
编译:陈聪聪、杨二一
The fate of the COVID pandemic may well be dictated by a biological building block that’s just several hundred nanometers long.
Messenger RNA, or mRNA, is at the heart of both leading vaccine candidates, one from Moderna and the other from Pfizer and partner BioNTech. The companies’ clinical trial data suggest these vaccines are about 95% effective. And Pfizer’s vaccine, which has already received the green light in the U.K., may start being distributed to certain Americans in just a matter of weeks.
It will be a distribution challenge and an immunization campaign the likes of which the world has never seen. But as remarkable as that challenge will be, the science that led to the creation of promising vaccines in less than a year is equally remarkable—a process that usually takes about five years or more. And in the case of Pfizer’s and Moderna’s vaccines, their pioneering technologies could make it far easier to scale up the manufacturing process.
So how does a vaccine get made, anyway? And how did academic institutes and pharmaceutical companies pull it off so quickly in the midst of a pandemic?
How a virus births a vaccine
Drugs don’t just spring out of thin air. Creating one, whether it be a therapeutic meant to treat disease or a vaccine meant to prevent it, is a fascinating process which begins with a thorough examination of the biological foe in question.
“One of the first steps of making a vaccine is to identify the weak spot in the pathogen; to identify the vaccine target,” says Peter Hotez, dean for the National School of Tropical Medicine at Houston’s Baylor College of Medicine.
The basic role of a vaccine is to induce an immune response, which will then offer protection against a pathogen by forcing your body to create antibodies which attack antigens, the components of a pathogen that produce the immune response. So when the actual virus comes knocking, your body already recognizes the intruder and can deploy its antibody arsenal.
Many common vaccines contain little bits of the virus or bacteria itself that either have been killed after being grown in a lab or are live but greatly weakened and are therefore unlikely to get you sick.
In the case of the coronavirus, identifying the “weak spot” Hotez refers to was the crucial first step. It’s something rather sinisterly named the spike protein.
“When you think of the coronavirus, everyone’s seen the pictures of the virus that has the colored spike protein, that red bit that’s protruding off that cylindrical virus compound,” says Dean Fanelli, a partner in the intellectual property department of Seyfarth Shaw LLP’s Washington, D.C., offices.
That “spike protein” does exactly what you’d think a spiked object would do: It pierces something else. “The spike protein attaches to the ACE2 protein present in human cells. And so we know that’s how this virus actually infects people,” adds Fanelli.
The drugmakers knew they would have to teach the body to attack the antibody-attracting antigens on the spike protein. But the way in which Pfizer and Moderna went about that is very different from the traditional vaccine creation method.
Creating a COVID mRNA vaccine
Messenger RNA is a powerful biological tool. It’s the molecule that actually instructs your cells what to make, such as proteins.
Theoretically, that means you could harness mRNA to turn your body’s cells into mini drugmaking factories that can fight various diseases. As little as a year ago, large swaths of the biotech community were skeptical of using mRNA technology to make treatments.
But that’s just what the leading vaccine candidates have been able to accomplish. By leveraging the genetic code of the virus, which was made available globally by Chinese scientists earlier this year, drugmakers have been able to figure out how to use mRNA to force the body to mimic the spike protein and induce an immune response.
In essence, they go back one step from the traditional vaccine-making process. Rather than injecting the surface proteins that awaken the immune system directly into the body, Pfizer/BioNTech and Moderna are injecting the RNA which codes for such proteins.
One individual who’s been a decided RNA vaccine evangelist is Phil Dormitzer, who just happens to be the vice president and chief scientific officer of Pfizer’s viral vaccines unit.
“I’ve been thinking about RNA vaccines for a long time,” he says. “Things really came together in 2018 when we agreed with BioNTech to start the new mRNA program.” That collaboration began as a quest to develop an mRNA-based flu vaccine. The focus shifted once the pandemic hit.
Dormitzer cites two specific reasons he’s enthusiastic about the technology: flexibility and the capacity to rapidly manufacture and scale up treatments. He explains that with RNA vaccines an immune response could produce both antibodies and T cells, another key immune system warrior, which is important since one or the other might be more effective against COVID.
The second reason is particularly critical at a time when these vaccines must be scaled up on a massive level for worldwide distribution.
“I think a lot of people gravitate to mRNA because you can make a piece of mRNA in a day, right?” says Baylor’s Hotez. “And there are companies that you can contract out that will make the mRNA for you.”
Unlike more traditional vaccines, you don’t have to spend months upon months manually harvesting and purifying a pathogen’s antigens in order to make the final product. You can simply let the instruction-carrying mRNA sequences loose into the body. After that, the body’s cells do that heavy lifting all by themselves.
That’s one of the reasons why Pfizer’s and Moderna’s vaccines may have leapfrogged competitors on the regulatory front—and what may help them ramp up hundreds of millions of vaccine doses by the end of 2021.
An army of COVID vaccines
Ultimately conquering the coronavirus pandemic will likely require a motley crew of vaccines which use different technologies. Not everything is going to be an mRNA vaccine.
For instance, Hotez’s own group has been working on a COVID-19 vaccine which employs a far more traditional technology called recombinant adenovirus tech.
“We started making the new spike protein as did other groups,” he says. “It’s just that different groups are using different technologies to do it, whether it’s mRNA or adenovirus. And each of the technologies has strengths and weaknesses.”
For Pfizer, one of the more complex issues is the ultracold temperature its COVID vaccine requires for storage, about negative 70 degrees Celsius. That’s precisely because of the mRNA component of its specific vaccine, which could fall apart without being thoroughly frozen. Pfizer even had to come up with a special high-tech storage and transport case to deal with that exact dilemma.
So while mRNA vaccines present some problems, the quickness they provide is exactly what’s needed in this moment. Distributing the COVID vaccines and persuading people to get them will be the next daunting challenge—and there are still plenty of other pioneering projects to come during this pandemic.






